Sulfato de Sódio: Fórmula, Propriedades, Estrutura, Aplicações
Sulfato de sódio (sal disódico de ácido sulfúrico, tetraoxidossulfato dissódico, sulfato de sódio, sal de Glauber, thenardite, mirabilite) é o composto inorgânico com a fórmula Na 2 SO 4 e seus hidratos relacionados. Todas as formas são sólidos brancos que são altamente solúveis em água.
É considerado um dos principais produtos químicos comercializados. Sua produção mundial (quase exclusivamente na forma de decaidrato) totaliza aproximadamente 6 milhões de toneladas por ano.

A noradita é o mineral sulfato de sódio anidro que é produzido em ambientes de evaporitos áridos, em cavernas secas, em antigas operações de mineração como eflorescência e como um depósito em torno de fumarolas.
Foi descrita pela primeira vez em 1825 em Salinas Espartinas (Ciempozuelos, Madri, Espanha) e foi nomeada thenardita em homenagem ao químico francês Louis Jacques Thénard (1777-1826).

O químico e farmacêutico holandês / alemão Johann Rudolf Glauber (1604-1670) descobriu em 1625, na água de uma nascente austríaca, o sulfato de sódio decahidratado (posteriormente conhecido como sal de Glauber). Ele chamou de sal mirabilis (sal miraculoso), devido às suas propriedades medicinais.
Entre 1650 e 1660, Glauber começou a fabricar sulfato de sódio a partir de sal comum (NaCl) e ácido sulfúrico concentrado. Este processo é considerado como o início da indústria química.
Seus cristais foram usados como laxante até o século XX.
No século XVIII, a reação do sal de Glauber com potássio (carbonato de potássio) começou a ser utilizada na produção industrial de carbonato de sódio (carbonato de sódio).

Atualmente é usado principalmente para a fabricação de detergentes e no processo Kraft para a produção de pasta de papel (o método dominante na produção de papel).
Depósitos minerais de sulfato de sódio são encontrados nos Estados Unidos, Canadá, Espanha, Itália, Turquia, Romênia, México, Botsuana, China, Egito, Mongólia e África do Sul.
Os principais produtores são a China (províncias de Jiangsu e Sichuan), seguida pela Espanha, onde se encontra o maior depósito de glauberita do mundo (em Cerezo de Río Tirón, Burgos).
A produção mundial total de sulfato de sódio natural é estimada em cerca de 8 milhões de toneladas, e aquela obtida como um subproduto de outros processos industriais entre 2 e 4 Mt.
Na Espanha, de acordo com informações publicadas no Inventário Nacional de Recursos de Sulfato de Sódio e outros dados atualizados, estoques estimados de minerais sulfato de sódio na ordem de 730 Mt catalogados como "reservas", e 300 Mt mais catalogados como "outros recursos" .

Na União Européia, a Espanha é atualmente o único país com minérios de sulfato de sódio (principalmente de Thenardite, Glauberite e Mirabilite).
Atualmente, há um declínio geral na demanda por sulfato de sódio no setor têxtil.
Nos últimos anos, outros setores, como detergentes, experimentaram algum crescimento, em certas regiões, devido ao baixo preço como matéria-prima.
Os principais mercados em expansão para detergentes de sulfato de sódio são encontrados na Ásia, América Central e América do Sul.
Fórmulas

Estrutura 2D


Estrutura 3D




Funcionalidades
Propriedades físicas e químicas

O sulfato de sódio pertence ao grupo reativo de compostos de sódio e também pertence ao grupo de sulfatos, hidrogênio-sulfatos e dissulfatos.
Inflamabilidade
É uma substância não combustível. Não há risco de explosão de seus pós.
Reatividade
O sulfato de sódio é muito solúvel em água e higroscópico. É muito estável, sendo não reativo para a maioria dos agentes oxidantes ou redutores em temperaturas normais. Em altas temperaturas, pode ser convertido em sulfeto de sódio por redução carbotérmica.
Substâncias quimicamente não reativas são consideradas não reativas sob condições ambientais típicas (embora possam reagir em circunstâncias relativamente extremas ou em catálise). Eles são resistentes à oxidação e redução (exceto em condições extremas).
Reações químicas perigosas
Quando o alumínio é fundido com sulfato de sódio ou potássio, ocorre uma violenta explosão.
Toxicidade
Substâncias quimicamente não reativas são consideradas não-tóxicas (embora substâncias gasosas neste grupo possam atuar como asfixiantes).
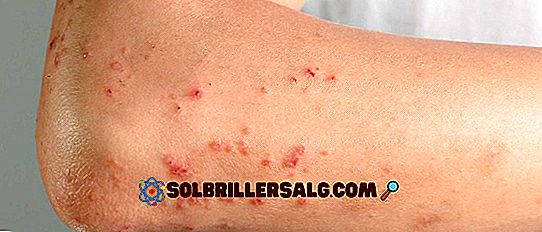
Embora o sulfato de sódio seja geralmente considerado não tóxico, ele deve ser manuseado com cuidado. O pó pode causar asma ou irritação ocular temporária. Este risco pode ser evitado através do uso de proteção para os olhos e uma máscara de papel.
Usos
Suas principais aplicações são na fabricação de:
- detergente em pó.
- polpa de papel
- têxteis
- vidro
- síntese de enzimas (produção de vinho).
- comida humana e animal.
- produtos de farmácia.
- química básica em geral.
- processos de aço.
- Detergente em pó
O sulfato de sódio é um material muito barato. Seu maior uso é como um enchimento em detergentes em pó domésticos, consumindo aprox. 50% da produção mundial. Os novos detergentes compactos ou líquidos não incluem o sulfato de sódio, portanto este uso está diminuindo.
Outro uso de sulfato de sódio que está diminuindo de importância, especialmente nos EUA. e no Canadá, está no processo Kraft para a fabricação de polpa de madeira. Avanços na eficiência térmica do processo, reduziu drasticamente a necessidade de sulfato de sódio.
A indústria do vidro fornece outra importante aplicação para o sulfato de sódio. É a segunda maior aplicação na Europa. O sulfato de sódio é usado para ajudar a eliminar pequenas bolhas de ar do vidro fundido.
No Japão, a maior aplicação de sulfato de sódio é na fabricação de têxteis. O sulfato de sódio ajuda os corantes a penetrarem uniformemente nas fibras e não corroem os recipientes de aço inoxidável usados no tingimento (ao contrário do cloreto de sódio, que é o método alternativo).
O sulfato de sódio é especialmente adequado para armazenar calor solar de baixa qualidade (para posterior liberação em aplicações de aquecimento) devido à sua alta capacidade de armazenamento de calor durante sua mudança de fase de sólido para líquido, que é dado a 32 ° C .
Para aplicações de resfriamento, uma mistura com sal comum de cloreto de sódio (NaCl) reduz o ponto de fusão para 18 ° C.
No laboratório, o sulfato de sódio anidro é amplamente utilizado como um agente de secagem inerte, para remover vestígios de água de soluções orgânicas. Sua ação é mais lenta que a do sulfato de magnésio, mas pode ser usada com uma variedade de materiais, pois é quimicamente bastante inerte.
O sulfato de sódio deca-hidratado (sal de Glauber) foi usado historicamente como laxante. É eficaz para a eliminação de certos fármacos como o acetaminofeno (acetaminofeno) do corpo após uma sobredosagem.
Outras aplicações para o sulfato de sódio incluem, seu uso como aditivo na fabricação de purificadores de carpete, como um aditivo na alimentação do gado, e na fabricação de amido.
Efeitos clínicos
Para suas aplicações terapêuticas, o sulfato de sódio pertence à categoria de laxantes salinos e catárticos utilizados no tratamento da constipação.
Os catárticos salinos são sais que retêm fluidos no intestino pela ação osmótica do sal não absorvido, produzindo um aumento no peristaltismo indireto.
Os catárticos salinos são pouco absorvidos pelo trato gastrointestinal, portanto, a toxicidade sistêmica é improvável, a menos que grandes quantidades tenham sido ingeridas. No entanto, grandes exposições podem causar desidratação e alterações eletrolíticas secundárias aos efeitos osmóticos do composto.
O abuso de laxantes crônicos pode ocorrer em pacientes com transtornos alimentares, síndrome de Munchausen ou transtornos factícios. Em geral, os pacientes apresentam náuseas, vômitos e diarréia associados a cólicas abdominais. Efeitos graves podem incluir desidratação, hipotensão, hipernatremia e anormalidades eletrolíticas.
Segurança e riscos
Advertências de perigo do Sistema Globalmente Harmonizado de classificação e rotulagem de produtos químicos (SGA).
O Sistema Globalmente Harmonizado para Classificação e Rotulagem de Produtos Químicos (SGA) é um sistema internacionalmente acordado, criado pelas Nações Unidas para substituir os diversos padrões de classificação e rotulagem usados em diferentes países através do uso de critérios globais consistentes. Unidos, 2015).
As classes de perigo (e seu capítulo correspondente do GHS), os padrões de classificação e rotulagem, e as recomendações para o sulfato de sódio são as seguintes (European Chemicals Agency, 2017, Nações Unidas, 2015, PubChem, 2017):
Classes de risco do GHS
H315: Provoca irritação da pele [Advertência Corrosão / irritação da pele - Categoria 2].
H317: Pode causar uma reação alérgica na pele [Sensibilização de Advertência, Categoria de Pele 1].
H319: Provoca irritação ocular grave [Aviso Lesões oculares graves / irritação ocular - Categoria 2A].
H412: Nocivo para os organismos aquáticos com efeitos adversos de longa duração [Perigoso para o ambiente aquático, perigo a longo prazo - Categoria 3].
(PubChem, 2017)
Códigos dos conselhos prudenciais
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 e P501.