química
As leis da estequiometria descrevem a composição das diferentes substâncias, com base nas relações (em massa) entre cada espécie que intervém na reação. Toda a matéria existente é formada pela combinação, em diferentes proporções, dos diferentes elementos químicos que compõem a tabela periódica. Estas uniões são
Ethanamide é uma substância química que pertence ao grupo de compostos nitrogenados orgânicos. Também recebe o nome de acetamida, de acordo com a União Internacional de Química Pura e Aplicada (IUPAC, por sua sigla em inglês). Comercialmente, é chamado amida de ácido acético. É chamado amida porque o nitrogênio é anexado a um grupo carbonila. É primário,
A reação de Maillard é o nome dado às reações químicas entre aminoácidos e açúcares redutores que obscurecem os alimentos durante a torrefação, assamento, torrefação e fritura. Compostos marrons são formados responsáveis pela cor e aroma de produtos como crosta de pão, rosbife, batatas fritas e biscoitos assados. A reação é favoreci
Cloreto de alumínio ou tricloreto de alumínio (AlCl 3 ) é um sal binário formado por alumínio e cloro. Às vezes aparece como um pó amarelo porque tem impurezas devido à presença de cloreto de ferro (III). É obtido combinando seus elementos. O alumínio, que tem três elétrons em seu último nível de energia (família IIIA), tende a produzi-los devido ao seu caráter metálico. Cloro com sete e
O ácido carboxílico é um termo que é atribuído a qualquer composto orgânico que contenha um grupo carboxilo. Eles também podem ser referidos como ácidos orgânicos e estão presentes em muitas fontes naturais. Por exemplo, o ácido fórmico, um ácido carboxílico, é destilado de formigas e outros insetos, como o besouro galerita. Isto é, um fo
O ácido alendrônico é um composto orgânico que pertence à classificação dos bisfosfonatos, especificamente os da segunda geração; Estes são aqueles que contêm átomos de nitrogênio. Este composto, assim como o restante dos bisfosfonatos, tem uma alta analogia estrutural com o pirofosfato inorgânico (PPi). O pirofosfat
Ácido fórmico ou ácido metanóico É o composto mais simples e menor de todos os ácidos orgânicos. É também conhecido como ácido metanóico e sua fórmula molecular é HCOOH, tendo apenas um átomo de hidrogênio ligado ao átomo de carbono. Seu nome deriva da palavra fórmica , que em latim significa formiga. Os naturalistas
O ácido tartárico é um composto orgânico cuja fórmula molecular é COOH (CHOH) 2 COOH. Tem dois grupos carboxilo; isto é, pode liberar dois prótons (H +). Em outras palavras, é um ácido diprótico. Além disso, pode ser classificado como um ácido américo (ácido acídico) e um derivado do ácido succínico. Seu sal é conhec
Cloreto de cálcio (CaCl 2) É um sal inorgânico composto de cálcio, metal alcalino-terroso e halogéneo de cloro. Nesse composto há várias interações eletrostáticas que definem a aparência externa de seus cristais e o restante de suas propriedades físicas. Além disso, é sempre acompanhado por moléculas de água, formando hidratos de fórmulas gerais CaCl2 · xH2O, com x = 0, 1, 2, 4 e 6. Quando x = 0, o
A reação exotérmica é um tipo de reação química na qual ocorre uma transferência de energia, principalmente na forma de liberação de calor ou luz. O nome vem do prefixo grego exo , que significa "para o exterior"; e o termo "térmico", que se refere ao calor ou temperatura. Nesse sen
Soluções químicas são conhecidas como misturas homogêneas em química. São misturas estáveis de duas ou mais substâncias nas quais uma substância (chamada soluto) se dissolve em outra (chamada solvente). As soluções adotam a fase do solvente na mistura e podem existir nas fases sólida, líquida e gasosa. Na natureza exis
A pirólise consiste em um processo de decomposição térmica onde as substâncias - de origem orgânica em sua grande maioria - são submetidas a altas temperaturas em um meio inerte (sem a presença de oxigênio). Quando a matéria orgânica é tratada por meio de pirólise, produtos que são usados no campo industrial são obtidos. Um dos elementos
A termoquímica é responsável pelo estudo das modificações caloríficas que são realizadas nas reações entre duas ou mais espécies. É considerada uma parte essencial da termodinâmica, que estuda a transformação do calor e outros tipos de energia para entender a direção na qual os processos se desenvolvem e como sua energia varia. Além disso, é
O nitrato de potássio é um sal ternário composto por nitrato de potássio, metal alcalino e oxoanião. Sua fórmula química é KNO 3 , o que significa que, para cada íon K +, há um íon NO 3 interagindo com ele. Portanto, é um sal iônico e constitui um dos nitratos alcalinos (LiNO 3 , NaNO 3 , RbNO 3 ...). KNO 3 é
A difenilamina é um composto orgânico cuja fórmula química é (C 6 H 5 ) 2 NH. Seu nome indica que é uma amina, bem como sua fórmula (-NH 2 ). Por outro lado, o termo "difenilo" refere-se à presença de dois anéis aromáticos ligados ao azoto. Por conseguinte, a difenilamina é uma amina aromática. Dentro do m
O cloreto de estrôncio é um composto inorgânico formado por estrôncio, metal alcalino-terroso (Becamgbara) e cloro halogéneo. Como ambos os elementos possuem eletronegatividades muito diferentes, o composto é um sólido iônico cuja fórmula química é SrCl 2 . Como é um sólido iônico, é constituído por íons. Para o caso de
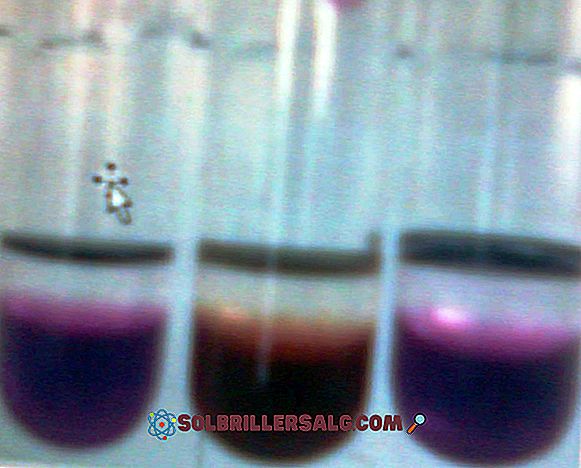
A fenolftaleína é um corante orgânico, que por sua vez é um ácido diprótico fraco, usado em muitas determinações volumétricas como indicador ácido-base. Isto é, se for um ácido diprótico, em solução pode perder dois íons H +, e para ser um indicador deve ter a propriedade de ser colorido na faixa de pH que está sendo avaliada. Em meio básico
Permanganato de potássio (KMnO 4) é um composto inorgânico formado por manganês - metal de transição do grupo 7 (VIIB) -, oxigênio e potássio. É um sólido vítreo roxo escuro. Suas soluções aquosas também são roxas escuras; Essas soluções tornam-se menos violetas à medida que são diluídas em grandes quantidades de água. O KMnO 4 então come
O óxido de estrôncio , cuja fórmula química é o SrO (não confundir com o peróxido de estrôncio, que é SrO2), é o produto da reacção oxidativa entre este metal e o oxigénio presente no ar à temperatura ambiente: 2Sr (s) + O2 (g) → 2SrO (s). Um pedaço de estrôncio queima em contato com o ar como consequência de sua alta reatividade e, por ter uma configuração eletrônica do tipo ns2, produz facilmente seus dois elétrons de valência, especialmente a molécula diatômica de oxigênio. Se a área da superfície d
O elétron diferencial ou diferenciado é o último elétron colocado na seqüência da configuração eletrônica de um átomo. Por que o nome dele é? Para responder a essa pergunta, a estrutura básica de um átomo é necessária: seu núcleo, vácuo e elétrons. O núcleo é um agregado denso e compacto de partículas positivas chamadas prótons e de partículas neutras chamadas nêutrons. Os prótons definem o n
A hidroxiapatita é um mineral de fosfato de cálcio cuja fórmula química é o Ca 10 (PO 4 ) 6 (OH) 2 . Juntamente com outros minerais e matéria orgânica permanece esmagado e compactado, forma a matéria-prima conhecida como rocha fosfórica. O termo "hidroxi" refere-se ao anião OH-. Se, ao invés daquele ânion, fosse flúor, o mineral seria chamado fluoroapatita (Ca 10 (PO 4 ) 6 (F) 2 , e assim com outros ânions (Cl-, Br-, CO 3 2-, etc.). A hidroxia
Fosfato de magnésio é um termo usado para se referir a uma família de compostos inorgânicos formados por magnésio, metal alcalino-terroso e oxoanion fosfato. O fosfato de magnésio mais simples tem a fórmula química Mg 3 (PO 4 ) 2 . A fórmula indica que para cada dois ânions PO 4 3- existem três cátions Mg2 + interagindo com estes. Além disso
O vidro Pyrex é um vidro borossilicato especial cuja marca (Pyrex) apareceu na cidade de Nova York em 1915, fabricada pela Corning Glass. Surgiu como um material para embalagens modernas de alimentos, também usado para armazenar e assar alimentos no mesmo tipo de recipiente. A origem da palavra Pyrex gerou certas discrepâncias, mas aceita-se que é derivada do artigo mais vendido nos momentos iniciais de sua comercialização: uma placa na qual um bolo foi assado. Com
Enantiômeros são aqueles pares de compostos orgânicos (e inorgânicos) que consistem em duas imagens espelhadas que não podem se sobrepor umas sobre as outras. Quando ocorre o oposto - por exemplo, no caso de uma bola, um taco de golfe ou um garfo - são considerados objetos aquirais. O termo quiralidade foi cunhado por William Thomson (Lord Kelvin), que definiu que um objeto é quiral se não puder se sobrepor à sua imagem especular. Por exe
Os metais não-ferrosos são todos aqueles que não possuem ou têm quantidades insignificantes de ferro. Estes, em diferentes proporções de massa, são usados para a criação de ligas que exibem melhores propriedades físicas do que os metais individuais. Assim, suas estruturas cristalinas e interações metálicas são a pedra angular das aplicações de ligas não ferrosas. No entanto, esses m
Precipitação ou precipitação química é um processo que consiste na formação de um sólido insolúvel a partir da mistura de duas soluções homogêneas. Ao contrário da precipitação de chuva e neve, neste tipo de precipitação "chove sólido" da superfície do líquido. Em duas soluções homogêneas, os íons são dissolvidos em água. Quando estes interagem co
O caráter metálico dos elementos da tabela periódica refere-se a todas aquelas variáveis, químicas e físicas, que definem os metais ou os distinguem de outras substâncias da natureza. São geralmente sólidos densos, brilhantes, duros, com altas condutividades térmicas e elétricas, moldáveis e dúcteis. No entanto, nem
Os sais de diazônio são compostos orgânicos nos quais existem interações iônicas entre o grupo azo (-N2 +) e um ânion X- (Cl-, F-, CH3COO-, etc.). Sua fórmula química geral é RN 2 + X-, e neste, a cadeia lateral R pode ser um grupo alifático ou um grupo arila; isto é, um anel aromático. A estrutura do íon arenodiazônio é representada na imagem inferior. As esferas azu
Os metais ferrosos são aqueles que contêm ferro (Fe), bem como pequenas quantidades de outros metais que são adicionados para dar certas propriedades benéficas às suas ligas. Embora o ferro possa existir em vários estados de oxidação, +2 (ferroso) e +3 (férrico) são os mais comuns. No entanto, o termo "ferroso" refere-se à presença de ferro, independentemente do seu estado de oxidação no material. O ferro é o
A teoria da banda é aquela que define a estrutura eletrônica do sólido como um todo. Pode ser aplicado a qualquer tipo de sólido, mas é nos metais onde seus maiores sucessos são refletidos. De acordo com essa teoria, a ligação metálica resulta da atração eletrostática entre os íons carregados positivamente e os elétrons móveis no cristal. Portanto, o c